弁理士二次試験(選択科目)
理工IV(生物)の「生物化学」の対策!
ウォーミングアップの続きです!
実験器具・試薬
実験機材
フローサイトメトリーについて説明せよ
フローサイトメトリーは、細胞を一列に並べてレーザー光を照射し、散乱光や蛍光を検出することで、個々の細胞の大きさ、内部構造、表面マーカーの発現などを迅速かつ定量的に解析することができる。 免疫細胞の分類や機能評価、がん細胞の特性解析などに利用される。
共焦点顕微鏡について説明せよ
共焦点顕微鏡は、光学顕微鏡の一種で、焦点面以外からの光を除去することで高解像度かつ高コントラストな画像を取得可能な顕微鏡である。細胞や組織の詳細な構造観察に広く利用されている。
クリーンベンチと安全キャビネットの違いを説明せよ。
クリーンベンチは試料の無菌環境を提供する装置で、主に試料の保護に特化している。一方、安全キャビネットは作業者、環境、試料を同時に保護する設計となっており、感染性物質や有害物質の取り扱いに適している。両者は空気の流れや保護対象において異なるため、使用目的に応じて適切な装置を選択することが重要である。

形は似ているけど、用途が全然違う
抗体
ポリクローナル抗体とモノクローナル抗体の違いを説明せよ
1つの抗体は1種類のエピトープを認識する。一般的に、動物を目的の抗原で免疫して得られる抗体には、目的の抗原の様々なエピトープを認識する抗体が混合しており、これをポリクローナル抗体という。一方、抗体の認識部位が同じになるように、単一の抗体産生細胞をクローニングして作られたものをモノクローナル抗体という。
ミエローマを用いたモノクローナル抗体の作製法を説明せよ。
まず目的の抗原でマウスを免疫し、その抗原を特異的に認識する抗体を生産するB細胞を増殖させる。次いで、そのマウスの脾臓もしくはリンパ節からB細胞を取り出す。B細胞の寿命は有限であるため、ミエローマ細胞と融合させることで無限に増殖する能力を合わせもつハイブリドーマを作成した後、1細胞単位で単離培養する。一つのB細胞からは一種類のエピトープを認識する抗体しか作られないため、ハイブリドーマを1細胞単位で単離した培地はモノクローナル抗体の安定かつ永続的な供給源となる。
モノクローナル抗体のポリクローナル抗体に対する利点を2つ挙げよ。
1. 高い特異性と再現性
モノクローナル抗体は、単一のB細胞クローンから得られるため、抗原の特定のエピトープに対してのみ結合する。これにより、他のタンパク質との交差反応が少なく、実験間での一貫性が保たれる。特に、同一の抗体を継代的に産生できるため、ロット間での性状のばらつきがなく、再現性の高い結果が得られる 。
2. 標的の微細な変化への高い感度
モノクローナル抗体は、特定のエピトープに対して高い親和性を持つため、標的の微細な構造変化や修飾に対しても敏感に反応する。これにより、精密な解析や高精度な検出が可能となる 。
基本的な実験手法
分離・解析法
薄層クロマトグラフィー法について説明せよ。
薄層クロマトグラフィー法は、液体クロマトグラフィーの一種で、低コストかつ手軽な分析法として知られている。ガラス板やアルミシートなどの表面にシリカゲル、アルミナもしくはポリアミド樹脂などを添付した薄層板を試料溶液中に立てかけるように入れる。溶媒は毛細管現象によって薄層に浸み込み上昇していき、展開が開始される。試料を分離した結果は、溶媒の移動距離と求めたい物質の移動距離の相対値(Rf値)を求めて評価する。
電気泳動法について説明せよ。
電気泳動法とは、電場をかけたゲルなどを通じて荷電分子を分離・解析する手法である。DNAやRNA断片の分離にはアガロースゲル電気泳動、タンパク質や小さなDNA断片の分離にはポリアクリルアミドゲル電気泳動、微量試料の分離にはキャピラリー電気泳動が用いられる。
検出・定量法
ウエスタンブロッティング法について説明せよ。
ウエスタンブロット法は、電気泳動によって分離したタンパク質を膜に転写し、任意のタンパク質に対する抗体でそのタンパク質の存在を検出する手法である。電気泳動の高い分離能と抗原抗体反応の高い特異性を組み合わせた手法であるため、細胞抽出液などの複雑なタンパク質溶液中に微量に含まれるタンパク質でも明瞭に検出することができる。特に不溶性のタンパク質、標識が困難なタンパク質、容易に分解されるタンパク質を取り扱う場合に有効である。
ELISA法について説明せよ。
ELISA法とは、抗体の特異性とシンプルな酵素測定法を組み合わせた技術で、試料中に含まれる抗原の濃度を検出・定量する際に用いられる。
サンドイッチ型 ELISA 法について説明せよ。
サンドイッチ型ELISA法は2つの抗体を使って行われるELISA法である。マイクロプレートに目的タンパク質に対する抗体を固相化し、目的タンパク質を反応させる。次いで酵素標識した目的タンパク質に対する別の抗体を反応させ、洗浄後、マイクロプレートに残る酵素活性を検出する。反応の特異性が高くなるため、高い検出精度を求められる場合に有効な方法である。欠点として、抗原の別々のエピトープを認識し、互いの結合を邪魔しない2種類の抗体の組み合わせが必要となる。
競合型ELISA法について説明せよ。
競合型ELISA法は試薬間の競合を利用して抗原の相対量を測定するELISA法である。マイクロプレートに目的タンパク質に対する抗体を固相化し、目的タンパク質及びあらかじめ分かっている酵素標識抗原を同一マイクロプレート内で同時に反応させる。そして、マイクロプレートに残る酵素活性を検出する。目的タンパク質が低分子であり2つの抗体の間に挟むことができない場合、この測定法が用いられる。
相互作用の解析
◆ タンパク質ータンパク質
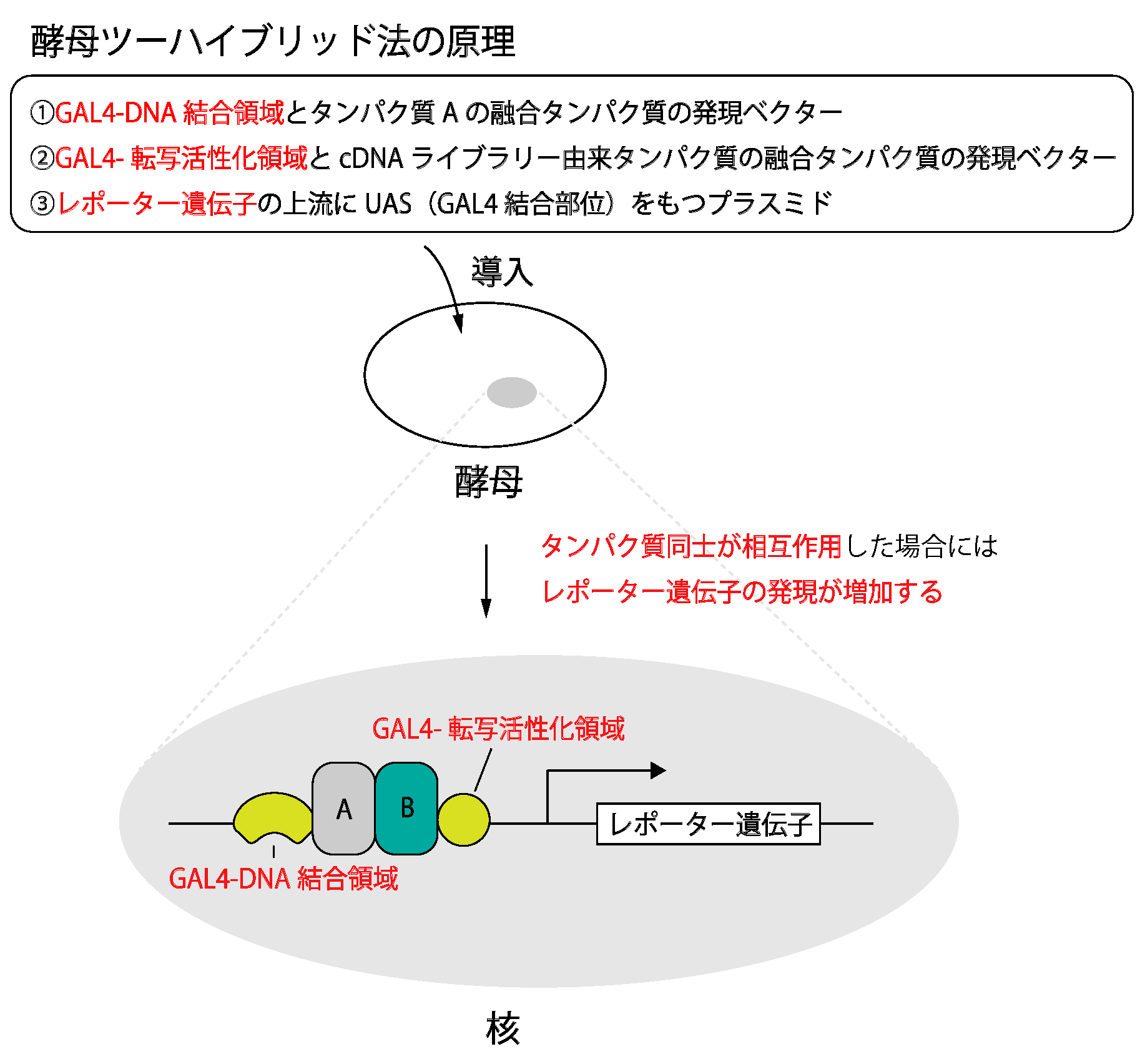
酵母ツーハイブリッド法について説明せよ。
酵母ツーハイブリッド法とは、酵母内に導入したレポーター遺伝子の転写活性化を指標に、タンパク質とタンパク質の相互作用を調べる手法である。まず組み換えDNA技術でDNA結合ドメインとタンパク質Aとの融合タンパク質の発現ベクターを準備する。次いで、組み換えDNA技術で転写活性化領域とタンパク質Bとの融合タンパク質の発現ベクターを準備する。最後に、これらの融合タンパク質を酵母内で発現させる。タンパク質Aとタンパク質Bが相互作用する場合は、DNA結合ドメインと転写活性化領域を含む複合体が形成され、レポーター遺伝子の転写が活性化する。相互作用するタンパク質のスクリーニングに適した手法である。

未知の結合パートナーを探す場合に有効
共免疫沈降法について説明せよ。
共免疫沈降法はまずタンパク質Aに対する抗体を準備し、ビーズに結合させておく。これをタンパク質A及びタンパク質Bを含む溶液に加えると、タンパク質Aと抗体が複合体を形成し、ビーズ上に捕捉され沈殿回収できる。最後に、ビーズに結合したタンパク質を溶出し、ポリアクリルアミドゲル電気泳動で解析する。タンパク質Aとタンパク質Bとの相互作用がある場合、タンパク質Aだけでなくタンパク質Bも検出される。

既知タンパク質の相互作用を生理的環境で検証する場合に有効
蛍光共鳴エネルギー移動(FRET)について説明せよ。
FRETとは、タンパク質とタンパク質の相互作用を調べる手法で、細胞内における距離や構造の変化をリアルタイムで測定する場合に有効である。まず組み換えDNA技術でタンパク質Aを指令するDNAの塩基配列を青色蛍光タンパク質を指令するDNAの塩基配列と結合させる。一方、タンパク質Bを指令するDNAの塩基配列を緑色蛍光タンパク質を指令するDNAの塩基配列と結合させる。最後に、これらの融合タンパクを細胞内で発現させ、紫色光を照射する。青色蛍光タンパクは紫色光で励起され青色光を発し、緑色蛍光タンパクは青色光で励起され緑色光を発するので、タンパクAとタンパクBが結合する場合、紫色光の照射により緑色光が検出される。

既知タンパク質の相互作用を細胞内で詳しく調べたい場合に有効
◆ DNAータンパク質
・ゲルシフト法(EMSA)について説明せよ。
特定の塩基配列をもつ長さのわかったDNA断片を放射性標識し、細胞抽出液と混ぜたのちにポリアクリルアミドゲル電気泳動を行う。タンパクが結合したDNA断片はゆっくりと流れるため、オートラジオグラフィーによって分析することで、タンパク質が結合したDNA断片を特定することができる。
・クロマチン免疫沈降法について説明せよ
細胞内で遺伝子調節タンパクと結合したDNAを抽出し、制限酵素あるいは超音波でDNAを切断する。目的の遺伝子調節タンパクに対する抗体を用いることでそのタンパクに結合したDNAを精製することができる。
分子構造解析
X線結晶構造解析の概要を3行程度で説明せよ
分子が三次元的に規則正しく並んだ結晶にX線を照射したときに生じる「回折像」から結晶中の電子分布を計算し、分子中の原子の配置を原子分解能で決定する手法である。
クライオ電子顕微鏡のX線結晶構造解析に対する利点を2つ挙げよ。
1. 結晶化が不要であること
X線結晶構造解析では、試料を結晶化する必要があるが、クライオ電子顕微鏡では試料を急速に冷却し、自然な状態を維持したまま解析を行うため、結晶化の必要がなく、柔軟で複雑な構造を持つ生体分子の研究に適している。
2. 複数の構造状態を同時に解析できる
X線結晶構造解析は、試料が単一の結晶状態であることを前提としているが、クライオ電子顕微鏡では複数の構造状態を同時に観察できる。これにより、分子の動的な変化や機能的な変遷を詳細に解析することができる。特に薬剤の結合状態やタンパク質の変性過程などの研究に有用である。
DNAの増幅
PCR法について説明せよ。
PCR 法は極めて微量の DNA サンプルから特定の DNA 断片を短時間に大量に増幅することができる方法である。PCR法は3つの試薬(プライマー、遊離ヌクレオチド、DNA合成酵素)を混交した溶液の温度を上げて下げるという一連の熱サイクルによって動作する。この熱サイクルの中で、二本鎖DNAの乖離、プライマーの結合、酵素反応によるDNA合成、という3つの反応が進み、最終的に特定領域のDNA断片が大量に複製される。
遺伝子発現の定量
DNAマイクロアレイ法(DNAチップ)について説明せよ。
DNAチップとは、数万から数十万に区切られた基板上に塩基配列の明らかな1本鎖のDNAを高密度に固定したものをいう。調べたい検体から抽出した遺伝子と基準となる標準検体を別々の蛍光色素で標識した後、DNAチップとハイブリダイゼーション反応をさせる。反応後、洗浄したDNAチップをスキャナーで読み取り、抽出した遺伝子と基準となる標準検体のシグナルの比を調べることにより、どのような遺伝子がどの程度発現しているかを網羅的に解析することができる。

偽陽性・偽陰性が起こりやすいため、リアルタイムPCRでの検証が必要!
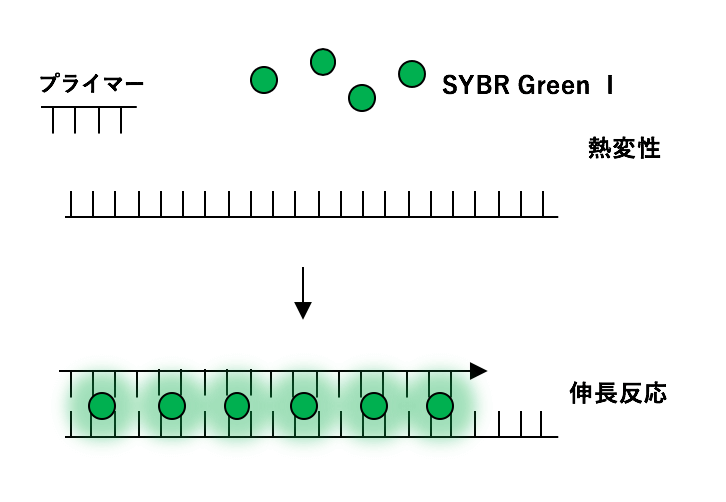
リアルタイムPCR法について説明せよ。
リアルタイムPCR法とは、PCRによる増幅産物をリアルタイムでモニタリングすることで、増幅率に基づいて初期のDNA又はRNAの定量ができる定量PCRのことをいう。
サザンブロッティング法について説明せよ
サザンブロッティング法とは、DNAサンプル中の特定の塩基配列を検出するための手法である。目的の細胞からDNAを抽出し、制限酵素で処理をする。次いで、作成したDNA断片をアガロースゲル電気泳動で分離した後、ニトロセルロース又はナイロン膜のメンブレンに転写する。そして、目的遺伝子をコードする塩基配列と相補的な塩基配列をもつ放射能標識又は蛍光標識プローブ配列をハイブリダイズさせる。メンブレンを洗浄した後、放射線感光フィルムなどを使用してバンドを視覚化する。目的遺伝子が存在する場合は、目的配列にハイブリダイズしたプローブが検出される。

古い手法だけど、長い断片や反復配列の検出に利用されるらしい
塩基配列の決定
サンガー法について説明せよ。
サンガ―法とは、DNA合成の材料として取り込まれるとDNAの伸長が止まる4種類のジデオキシリボヌクレオシド三リン酸(ddATP、ddGTP、ddCTP、ddTTP)を用いた塩基配列決定法である。配列を決定したいDNAにジデオキシリボヌクレオシド三リン酸いずれか1種類を加え4つのDNA合成を行う。各反応では配列の異なる位置で伸長が止まった一連の産物ができる。この4つの反応産物を4つのレーンに並べてポリアクリルアミドゲル電気泳動で展開し、ゲルの下から順にバンドを読み取ることで、塩基配列を決定することができる。
マキサム・ギルバート法について説明せよ。
塩基配列を決定したい二本鎖DNAを一本鎖DNAに分離した上で、5’末端を放射性リンで標識する。次いで、4種類の塩基特異的なDNA切断溶液をいずれか一種類ずつ加え、DNA断片の切断を行う。この4つの反応産物を4つのレーンに並べてポリアクリルアミドゲル電気泳動で展開すると断片のサイズごとに分離される。最後にオートラジオグラムにかけてバンドを下から読み取っていくことでDNAの塩基配列を決定できる。
全ゲノム解析について説明せよ。
全ゲノム解析とは生物がもつすべてのDNA配列を一度に読み取る技術である。調べたい生物からDNAを抽出し、数百塩基程度の短い断片となるように切断する。断片の両端にアダプターを付加し、PCR法などで増幅させる。これを次世代シーケンサーで読み取ることで、全ゲノムの塩基配列を決定する。
主要なシーケンス技術
– イルミナ: 蛍光標識したヌクレオチドを読み取り
– パックバイオ: 合成されるDNA鎖をリアルタイムで観察
– ナノポア: DNAに伴う電流変化で読み取り
– SOLiD: 4色の蛍光標識プローブで読み取り
遺伝子導入
DNAを細胞に導入するためのトランスインフェクション技術は大きく3種類に分類され、細胞質又は核に直接導入する( ① )遺伝子導入法、( ② )遺伝子導入法、遺伝子組み換えウイルスを介して導入する( ③ )遺伝子導入法がある。
① 物理的
② 化学的
③ 生物学的
物理的導入法を3つ説明せよ。
エレクトロポテーション法
電気パルスを用いて一時的に細胞膜に孔を形成し、その孔を介して、プラスミドを細胞内に通過させる。高価な機材を必要とするが、操作が簡単で遺伝子導入効率も高い。
マイクロインジェクション法
極細のガラス針を用いて、細胞に直接遺伝子を注入する方法である。高い導入効率と精密な操作が可能だが、高度な技術を要する。
遺伝子銃法
微小な金属粒子に遺伝子を付着させ、高圧ガスで細胞に打ち込む。細胞へのダメージが大きくなる場合がある。
化学的導入法を2つ説明せよ。
リン酸カルシウム共沈殿法
リン酸カルシウムとプラスミドDNAを混合すると、リン酸カルシウム-プラスミドDNA共沈殿物が生じ、この沈殿を培養細胞の上に乗せるとエンドサイトーシスにより細胞内へ取り込まれる。特殊な装置や技術を必要とせず、操作も比較的簡単な化学的遺伝子導入法である。
リポフェクション法
陽電荷を持つ脂質に遺伝子を包み込み、細胞膜と融合させて遺伝子を導入する。細胞への毒性が比較的低く、幅広い種類の細胞に適用できる。
生物学的導入法を1つ説明せよ。
ウイルスベクター法
ウイルスをベクターとして利用し、遺伝子を細胞に導入する方法である。高い導入効率と安定した遺伝子発現が期待できるが、ウイルスの種類によっては免疫反応を引き起こす可能性がある。
RNA干渉法
siRNAを用いたRNA 干渉法について説明せよ。
RNA干渉とは2本鎖RNAが特定の遺伝子の発現を抑制する現象である。標的とする遺伝子と塩基配列が同じ2本鎖RNAを細胞内に導入すると、ダイサーと呼ばれる酵素によって分解され、二本鎖の短いRNA(siRNA)となる。次いで、二本鎖siRNAは一本鎖siRNAに分離された後、RISC複合体に組み込まれ、標的メッセンジャーRNAへと導くガイド役として機能する。その後、ガイド鎖が標的メッセンジャーRNAと相補対を形成するとRISC複合体内のAgoタンパク質による標的メッセンジャーRNAの切断を誘導する。
RNA干渉法を応用する際の注意点は?
siRNAの長さが約21塩基と短く標的遺伝子とは無関係な遺伝子の発現まで抑制されてしまう現象(オフターゲット)に注意する必要がある。
話題の研究(日本人)
がん免疫療法
2018年ノーベル生理学医学賞
本庶佑先生
自然免疫について説明せよ。
自然免疫は体内に侵入してきた病原体や異常になった自己の細胞をいち早く感知し、それを排除する仕組みのことである。一つの分子が多種の異物や病原体に反応することができるが、特定の病原体に繰り返し感染しても自然免疫が増強することはない。
獲得免疫について説明せよ
獲得免疫は感染した病原体を特異的に見分け、それを記憶することで同じ病原体に出会ったときに効果的に病原体を排除する仕組みのことである。自然免疫に比べると応答までにかかる時間が長い反面、病原体に対して強い殺傷能力を示す。
がん免疫療法に用いられるメカニズムについて説明せよ
がん免疫療法とは免疫機能を利用してがん細胞を攻撃する治療法である。最近の研究では、がん細胞が免疫の働きにブレーキをかけていることがわかり、そのブレーキを解除する方法として、免疫チェックポイント阻害療法が注目されている。免疫チェックポイント阻害剤の一つニボルマブは、がん細胞のPD-L1とT細胞のPD1との結合を阻害する。
オートファジー
2016年ノーベル生理学医学賞
大隅良典先生
オートファジーについて簡単に説明せよ。
細胞内で不要な成分や損傷した細胞小器官を隔離膜が包み込み、オートファゴソームと呼ばれる小胞を形成する。その後、オートファゴソームはリソソームと融合し、内部の物質が分解する。分解された成分は再利用され、新たなエネルギー源や細胞構成要素として活用される。
ユビキチン・プロテアソームシステムとオートファジーの違いについて説明せよ
ユビキチン・プロテアソームシステムは、ユビキチンが共有結合した標的タンパク質をプロテアソームが認識し選択的に分解するシステムのことをいう。一方、オートファジーは、細胞内部の不要物質をオートファゴゾームという膜で包み込み、リソソームと融合することで、それら不要物質を分解することをいう。ユビキチン・プロテアソームシステムはタンパク質を標的とするが、オートファゴソームはオルガネラなど大きなレベルで分解する。
大隅先生は、オートファジーの全容を光学顕微鏡で初めて観察し、電子顕微鏡でその過程を解明。14の主要な遺伝子「ATG遺伝子」を発見しました。ベルギーの生化学者 クリスチャン・ド・デューブ博士によって提唱されたオートファジーは、半世紀以上の時を経てそのメカニズムが大きく解明されました。
エバーメクチン
2015年ノーベル生理学医学賞
大村智先生
抗寄生虫薬としてのエバーメクチンの作用機序を説明せよ。
無脊椎動物の神経細胞及び筋細胞に存在するグルタミン酸作動性Cl−チャネルに結合し、Cl−に対する細胞膜の透過性を上昇させる。これによって、Cl−が細胞内に流入し神経細胞や筋細胞の過分極が生じる。無脊椎動物は麻痺を起こし死滅する
ブユに刺されることで感染するオンコセルカ症は失明を含む重大な目と皮膚の疾患を引き起こします。アフリカの流行地では60%以上の住民が目の疾患に悩まされており、4%が失明に至っておりました。大村先生の発見によって開発されたエバーメクチンは、半年~1年に一度の服用で感染をコントロールでき、60万人の失明が防がれたといわれています。
iPS細胞
2012年ノーベル生理学医学賞
山中伸弥先生
体細胞をリプログラミングする方法を二通り、説明せよ。
従来、受精卵から個体が形成されていく過程は一方向性であり、一度分化した細胞は元の未分化細胞に戻れないと考えられていたが、分化した体細胞核を卵子の細胞質に移植すると受精卵の状態に戻ることが知られている。最近では、ウイルスベクターによって初期化因子を体細胞へ導入すると多能性を持つ細胞が誘導されることが発見された。
ES 細胞と iPS 細胞の作製方法を説明せよ。
ES細胞は、受精卵が胚盤胞と呼ばれる段階まで発生したところで内部細胞塊を取り出し、フィーダ細胞という下敷きとなる細胞と一緒に培養することで作成される。一方、iPS細胞は、レトロウイルス・ベクターを使って4つの遺伝子を体細胞に導入することで作成される。

4つの遺伝子とは、Oct3/4、Sox2、Klf4、c-Myc
ES 細胞に対する iPS 細胞の利点を論ぜよ。
ヒトES細胞を作成するには「生命の萌芽」と位置付けられるヒト受精卵の破壊を伴うことから倫理的な問題があるとされていた。また、細胞移植治療に応用する際、患者とは他人の細胞であることから、免疫拒絶反応が惹起されてしまう可能性が高い。一方、iPS細胞は体細胞から作られるため、倫理的な問題には該当せず、患者さん自身の細胞から作成することができるため、分化した組織や臓器の細胞を移植する際、拒絶反応が起こりにくいと考えられている。
ES細胞を用いたノックアウトマウスの作り方を説明せよ
まずノックアウトしたい遺伝子を確定し、ゲノムライブラリーの情報に基づいてターゲティングベクターを作成する。次いで、ターゲティングベクターをエレクトロポレーション法でES細胞に導入した後、相同組み換えが起きたES細胞を単離する。相同組み換えが起きたES細胞を胚盤胞にインジェクションし、マウスの子宮に入れるとキメラマウスが産まれる。このキメラマウスはノックアウトしたい遺伝子が欠損した細胞と正常な野生型の細胞を併せ持っている。キメラマウスと野生型のマウスを交配することで、完全に遺伝子が欠損したマウスを作成することができる。
話題の研究(世界)
miRNA
2024年ノーベル生理学医学賞
ビクター・アンブロス氏 (アメリカ)
ゲイリー・ラブカン氏 (アメリカ)
マイクロ RNA の生合成過程について、以下の語を全て用いて6行程度で説明せよ。
[pri-miRNA, Drosha, pre-miRNA, Exportin5, Dicer, 2本鎖mature miRNA, Ago, RISC複合体]
まず核内において、RNAポリメラーゼIIを介した転写によりpri-miRNAが産生される。次いで、RNase III系酵素であるDroshaにより切断されpre-miRNAが産生される。その後、Exportin5を介して核より細胞質へと移送される。細胞質では別のRNaseIII酵素であるDicerの触媒反応により2本鎖mature miRNAが産生される。2本鎖mature miRNAはAgoタンパク質に取り込まれ、片方のRNA鎖だけがAgoタンパク質と安定な複合体を形成し、RISC複合体を形成する。この一本鎖化されたmature miRNAが遺伝子発現制御のガイド役として働く。
マイクロ RNA による遺伝子発現抑制機構について簡単に説明せよ。
マイクロRNA(miRNA)による遺伝子発現抑制機構で中心的な役割を果たすのがAgoタンパク質である。miRNAとAgoタンパク質の複合体であるRISC複合体は、RISCに取り込まれたmiRNAと部分的に相補的な配列を有する標的mRNAと結合し、その標的mRNAのタンパク質への出力を抑制する。これまでの研究でさまざまなAgoタンパク質が存在することがわかっており、標的mRNAの切断、mRNA分解反応促進、翻訳反応抑制などにより、標的mRNAのタンパク質への出力を抑制していると考えられている。
mRNAワクチン
2023年ノーベル生理学医学賞
カタリン・カリコ氏 (ハンガリー/アメリカ)
ドリュー・ワイスマン氏 (アメリカ)
mRNAワクチンと従来のワクチンの違いを説明せよ。
従来型のワクチンは、標的となる病原体を弱毒化又は不活化したものを注射することで、その病原体に対する免疫力を高めるものであった。一方、mRNAワクチンは標的となる病原体の設計図であるmRNAを注射し、体内でその病原体を構成する一部のタンパクを作らせることで、その病原体に対する免疫力を高めるものである。
mRNAワクチンは標的となる遺伝子配列がわかれば迅速に設計及び製造が可能であり、従来型よりも短時間でワクチンを開発することができる。その一方、従来型は常温又は冷蔵保存が基本であったが、mRNAワクチンは分解されやすいため冷凍保存を要する製品が多い。
mRNAワクチンの課題は?
mRNAワクチンを構成するmRNAは免疫原性があり、酵素分解を受けやすく、また細胞に取り込まれないため、そのままの状態で体内に注入することができない。そこで、脂質ナノ粒子(LNP)が活用されている。イオン化脂質、PEG化脂質、コレステロール及び中性リン脂質で構成されたLNPがmRNAを包み込むことで循環中の分解から保護される。その後、エンドソームによって細胞内に取り込まれた後、細胞質にmRNAが放出され、リボソームによって目的のタンパク質が発現する。
温感と触覚の受容体
2021年ノーベル生理学医学賞
デヴィッド・ジュリアス氏 (アメリカ)
アーデム・パタプティアン氏 (アメリカ)
ジュリアス氏は温感に関与する( ① )の発見、パタプティアン氏は触覚に関与する( ② )を発見した。( ② )は血圧、呼吸、膀胱制御などの生理機能調整にも関与している。
① TRPチャネル(一過性受容体電位型チャネル)
② PIEZOチャネル
C型肝炎
2020年ノーベル生理学医学賞
ハーベイ・オルター氏 (アメリカ)
マイケル・ホートン氏 (カナダ)
チャールズ・ライス氏 (アメリカ)
C型肝炎について説明せよ。
C型肝炎はC型肝炎ウイルスによって起こる肝臓の病気で、一度感染するとおよそ70%の人が持続感染になるとされてる。肝臓は、ウイルスによって慢性肝炎になっても自覚症状がほとんどない場合もあり、気がつかないまま放置すると、20年から30年かけて肝硬変や肝がんへと進行する。感染予防として、血液との接触を避けることが重要で、早期発見と抗ウイルス薬などの投与により病気の侵攻を防ぐことができる。
CRISPR-Cas9
2020年ノーベル生理学医学賞
エマニュエル・シャルパンティエ氏 (フランス)
ジェニファー・ダウドナ氏 (アメリカ)
CRISPR/Cas9 を用いた遺伝子ノックアウト法を説明せよ。
原核生物において発見された獲得免疫機構をCRISPR/Casといい、このうちCas9タンパク質と呼ばれるエンドヌクレアーゼと標的となるDNA配列へ導くガイドRNAを複合化し、DNA改変技術に応用したものをCRISPR/Cas9という。
ノックアウトしたい遺伝子のPAM領域の直前に位置するDNA配列とDNA-RNA塩基対を形成するようにガイドRNAを調整する。すると、ガイドRNAによってCas9タンパク質が標的としたDNA配列部位に動員される。Cas9タンパク質はエンドヌクレアーゼ活性により、標的DNA配列部位に二本鎖切断を作る。二本鎖切断された部位は非相同組み換え修復が行われるが、この過程で誤りを生じやすい。誤りを生じるとフレームシフトを引き起こし、遺伝子を崩壊させることとなる。 CRISPR/Cas9の技術により、狙った遺伝子を短時間かつ高効率で改変することが可能となった。
CRISPR/Cas9を用いた遺伝子ノックアウトマウスの作成法を説明せよ。
まず標的となるDNA配列とDNA-RNA塩基対を形成するようにガイドRNAを調整する。次いで、調整したガイドRNAとCas9タンパク質をウイルスベクターもしくはエレクトロポテーションによりマウスの受精卵に導入し、別のマウス(仮親)の卵管に移植する。受精卵のゲノムDNAは、ガイドRNAによって標的配列にCas9タンパク質が動員され、Cas9タンパク質のエンドヌクレアーゼ活性によって、二本鎖切断が作られる。ゲノムDNA自身の修復機構により非相同組み換え型修復が行われるが、この過程で誤りを生じやすくゲノムDNAの標的遺伝子を崩壊することとなる。そして、仮親から産仔を取得し、目的領域の塩基配列の確認を行う。
CRISPR/Cas9 システムを用いて、内在遺伝子Aから発現するタンパク質AのC末端にGFP が融合したノックインマウスを作製したい。その方法について、以下の語を全て用いて5行程度で説明せよ。また、用いた語には下線を引け。なお、以下の語はそれぞれ複数回用いても良い。
[マウス受精卵、Cas9 タンパク質、ガイド RNA、ターゲッティングベクター、相同組換え]
まず遺伝子Aを含むDNA配列とDNA-RNA塩基対を形成するようにガイドRNAを調整する。次いで、遺伝子AのC末端にGFPを融合させたDNA配列を含むターゲッティングベクターを作成する。そして、Cas9タンパク質及び調整したガイドRNAとターゲティングベクターをマウス受精卵に導入し、別のマウス(仮親)の卵管に移植する。マウス受精卵のゲノムDNAは、ガイドRNAによって標的配列にCas9タンパク質が動員され、Cas9タンパク質のエンドヌクレアーゼ活性によって、二本鎖切断が作られる。すると、ターゲティングベクターを参照して相同組み換え修復が行われ、遺伝子AのC末端にGFPを結合させたDNA配列が組み込まれる。そして、仮親から産仔を取得し、目的領域の塩基配列の確認を行う。
低酸素応答
2019年ノーベル生理学医学賞
ウィリアム・ケリン氏 (アメリカ)
ピーター・ラトクリフ氏 (イギリス)
グレッグ・セメンザ氏 (アメリカ)
低酸素誘導因子について説明せよ。
通常、低酸素誘導因子であるTIFはユビキチン・プロテアソームシステムにより抑制されているが、酸素供給が不足するとユビキチン化が抑制されて、発現量が増加する。TIFは転写因子として、血管新生、細胞増殖、糖代謝、pH調整及びアポトーシスなど様々な遺伝子の発現に関与する。
参考情報
ノーベル生理学医学賞
| 2024年 | miRNAと転写後の遺伝子発現の調節におけるその役割の発見 |
| 2023年 | 新型コロナウイルス感染症に対する効果的なmRNAワクチンの開発を可能にしたヌクレオシド塩基修飾に関する発見 |
| 2022年 | 絶滅したヒト族のゲノムと人類の進化に関する発見 |
| 2021年 | 温感と触覚の受容体の発見 |
| 2020年 | C型肝炎ウイルスの発見 |
| 2019年 | 細胞による酸素量の感知とその適応機序の解明 |
| 2018年 | 免疫チェックポイント阻害因子の発見とがん治療への応用 (2020年度出題) |
| 2017年 | 概日リズムを制御する分子メカニズムの発見 (2022年度出題) |
| 2016年 | オートファジーの仕組みの解明 |
| 2015年 | 感染症に対する新たな治療法に関する発見 |
ノーベル化学賞
| 2024年 | コンピュータによるタンパク質設計手法・構造予測プログラムの開発 |
| 2023年 | 量子ドットの発見と合成 |
| 2022年 | クリックケミストリーと生体直交化学の開発 |
| 2021年 | 不斉有機触媒の開発 |
| 2020年 | ゲノム編集手法の開発 (2022年度出題) (2017年度出題) |
| 2019年 | リチウムイオン二次電池の開発 |
| 2018年 | 酵素の指向性進化法の開発/ペプチドおよび抗体のファージディスプレイ法の開発 |
| 2017年 | 溶液中で生体分子を高分解能構造測定するためのクライオ電子顕微鏡の開発 (2024年度出題) |
| 2016年 | 分子マシンの設計と合成 |
| 2015年 | DNA修復の仕組みの研究 (2024年度出題) |
過去問リンク
- 2024年度の過去問(生物化学)
- 2023年度の過去問(生物化学)
- 2022年度の過去問(生物化学)
- 2021年度の過去問(生物化学)
- 2020年度の過去問(生物化学)
- 2019年度の過去問(生物化学)
- 2018年度の過去問(生物化学)
- 2017年度の過去問(生物化学)
- 2016年度の過去問(生物化学)
- 2015年度の過去問(生物化学)
- 2014年度の過去問(生物化学)
- 2013年度の過去問(生物化学)







Comment